J. E. Davies – Torontó Egyetem
A köldökzsinór szövet értéke az extracelluláris mátrixban található sejtekben rejlik. A szövet maga nem mutat terápiás értéket, de az elmúlt 5 év átlaga alapján a köldökzsinór szövet képviseli jelenleg a mesenchymális őssejtek leggazdagabb forrását a humán klinikai kutatásokban7.
Napjainkban azon leendő szülők közül, akik a köldökvér tárolása mellett döntenek Ázsiában, Európában és Észak-Amerikában, 57 %-nak lenne lehetősége a köldökzsinór szövet, vagy a belőle származó őssejtek tárolására is. 1
Ami engem aggaszt, az az, hogy ez az arány a nyugati féltekén sem sokkal magasabb, illetve csupán egy nyilvános adattár létezik a Wharton kocsonya eredetű mesenchymális sztróma sejtekre (őssejtekre).
Pedro Silva Couto nyilatkozata szerint egy korábbi hírlevélből:
“A szülőknek, akik szeretnék tároltatni a köldökzsinór szövet mesenchymális őssejtjeit utána kell nézniük, hogy pontosan milyen szolgáltatásokat kínálnak az őssejtbankok, hogyan teljesítenek a minőségellenőrzési teszteken, valamint, hogy milyen garanciát vállalnak a minta kiadására transzplantáció céljából.”2
De van két kirívó probléma ezek között az egyébként tökéletesen bölcs tanácsok között. Először is azt feltételezi, hogy a leendő szülők vagy nagyszülők kellő ismerettel rendelkeznek ahhoz, hogy megfelelően ítéljék meg a sejtbankok által leírt folyamatokat és igényeket, viszont ennek nagyon kicsi a valószínűsége. Másod sorban azt is feltételezi, hogy a szülők képesek lennének megfelelően értékelni a szóban forgó cégek által felmutatott garanciákat.
Közülük sokan összemossák a köldökzsinór szövet, valamint a belőle származó sejtek begyűjtését és a velük végzett alap- és klinikai kutatásokat, így nem jutnak tiszta és következetes információkhoz, melyek nem csak a szülők, hanem a nekik tanácsot adó orvosok segítségére is lehetnek.
Bizonyos tények a köldökzsinórral kapcsolatban hagyományos bölcsességekké váltak: pl. tudjuk, hogy a köldökzsinór szövet gazdag forrása a mesenchymális őssejteknek. Tudjuk, hogy a perinatális szövetek jobb őssejt forrásként szolgálnak, mint a felnőtt szövetek, hiszen ezek a sejtek késleltetve öregednek viszont gyorsan szaporodnak.
Mégis zavaró, hogy a köldökzsinór szövet anatómiai jellemzőit a közvélemény nem ismeri. Sőt, gyakran a sejtek izolálásának módszeréről szóló tudományos és kereskedelmi leírások sem biztosítanak kellő átláthatóságot. Ezek a problémák együttesen akadályozzák a tudományos előre haladást ezen a területen, valamint megnehezítik, hogy a sejtbanki társaságok egyértelműen tudják közölni a szolgáltatásaikat, hogy a szülők képesek legyenek teljes mértékben tájékozott döntést hozni.
Az alábbiakban 3 témával fogok foglalkozni:
- Milyen a köldökzsinór szerkezete és milyen sejtek tudunk begyűjteni belőle?
- Milyen sejteket alkalmaznak jelenleg a sejtterápiákban, melyekben köldökzsinór szövetet használnak fel?
- Milyen betegségeket kezelnek ma köldökzsinór sejtekkel?
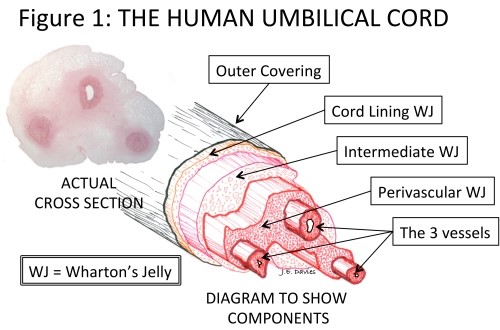
- kép: Az emberi köldökzsinór
Diagram to show components: Diagram, ami az összetevőket mutatja
Wharton’s Jelly: Wharton kocsonya, Actual cross section: tényleges keresztmetszet, Outer covering: külső fal, Cord Lining WJ: köldökzsinór Wharton kocsonya belső fal, Intermediate WJ: középső Wharton kocsonya, Perivascular WJ: perivaszkuláris Wharton kocsonya, The 3 vessels: a 3 ér
A köldökzsinór struktúrája
A köldökzsinór természetesen az édesanya (méhlepény) és a fejlődő baba (magzat) összekapcsolására szolgál. Ez a kötél-szerű szerkezet egy nagyon vékony külső köpenyből és három érből áll, melyek biztosítják a tápanyagok közlekedését a magzat és a méhlepény között. A terhesség előrehaladtával és a baba növekedésével, az egészséges és megfelelő vérellátás életbevágóan fontossá válik. A köldökzsinór mind hosszában, mind kerületében rohamosan növekszik, hogy alkalmazkodni tudjon a nélkülözhetetlen tápanyagok transzportjához. Az erek támogatására, illetve, hogy ne gubancolódjanak össze, amikor a baba elkezd mozogni az anyaméhben, körülveszi őket speciális és egyedi, párnázott kötőszövet, amit Wharton kocsonyának nevezünk (WJ) – 1. kép3
A probléma az ezzel a látszólag egyszerűnek tűnő történettel, hogy a WJ-t különböző szerzők különféle módokon írták le. Például, a kifejezést néha a köldökzsinór enzimatikus emésztése által izolált összes sejt leírására használják.4 Csak a köldökzsinór WJ belső falából és a WJ perivaszkuláris zónájából származó sejtek izolálását írták le kellő részletességgel – és képezi sok szabadalom tárgyát – hogy lehetővé tegyék az ezekből a régiókból származó sejtek izolálását, a többi kizárásával. Azonban a perivaszkuláris zóna leírásai szerint annak kiterjedése csupán 2 sejtsornyi5, lényegi szerkezetét pedig az 1. kép mutatja.
A köldökzsinór szövet ilyen leírásbeli különbségei miatt tisztán látszik, milyen nehéz, hogy ne csak megértsük a különbségeket az őssejt bankok által kínált szövet szolgáltatások között, hanem értelmezni tudjuk az adatokat, melyek tudományos vagy klinikai kutatásokból származnak. Ezt mutatjuk be részletesebben egy olyan alapítványon keresztül, mely az emberi köldökzsinór struktúrájának megegyezéses leírásán alapszik6. Ha a szakmabeliek közös megállapodásra jutnak, és azt egyértelműen közlik, sokkal könnyebb lesz a szülőknek is ezt a fontos döntést meghozni.
A kérdés tehát: szövet vagy célzott sejtek?
Thomas Wharton angol orvos volt az első, aki leírta a “Wharton kocsonyát” egy 1656-ban publikált (latin nyelvű) könyvben. Fogalma sem volt róla, hogy a kocsonya sejteket tartalmaz – és természetesen arról sem, hogy a mesenchymális őssejtek valaha leírt leggazdagabb forrása – mivel a sejteket magukat, csak 9 évvel később fedezte fel a híres angol tudós, Robert Hooke!
Wharton TW. (1656) Adenographia. Fordítás: S. Freer. Oxford University Press, Oxford, U.K.
A köldökzsinór szövet értéke az extracelluláris mátrixban található sejtekben rejlik. A szövet maga nem mutat terápiás értéket, de az elmúlt 5 év átlaga alapján a köldökzsinór szövet képviseli jelenleg a mesenchymális őssejtek leggazdagabb forrását a humán klinikai kutatásokban7.
Természetesen a köldökzsinór szövet sok típusú sejtet tartalmaz – amnion epitélium sejteket, Wharton kocsonya sejteket, endoteliális sejteket az erek belső falából, illetve a 3 ér falából származó simaizom sejteket. Ezek közül csak a Wharton kocsonya az, amelyről számos tanulmány kimutatta, hogy a mesenchymális őssejtek gazdag forrása – és egyedül a mesenchymális őssejtek azok, melyekre manapság hangsúlyt fektetnek szinte az összes “köldökzsinór szövettel” végzett klinikai tanulmányban7. Valóban, a mesenchymális őssejtek az egyetlen típusú őssejtek, melyeket megtaláltak a köldökzsinór szövetben. A köldökzsinór szövet klinikai értéke ezért a Wharton kocsonya sejtjeiben marad. A nyilvánvaló kérdés az lenne: Hol találjuk ezeket a fontos sejteket a Wharton kocsonyában?
A válasz igen egyszerű. Általában a mesenchymális őssejtek az egész felnőtt szervezetben megtalálhatók – de mindig vérerek közelében – és a köldökzsinór sem kivétel. Szóval a köldökzsinór mesenchymális őssejtjeinek túlnyomó többsége a 3 vérér körül található, az úgynevezett perivaszkuláris régióban (lásd 1. kép) és képesek a kocsonya funkcionális sejtjeivé (myofibroblasztokká) differenciálódni8.
A mesenchymális sejtekre elfogadott hivatalos teszt a Kolóniaformáló Fibroblaszt Egység Teszt (CFU-F). Sarugaser és társai (2005) bemutatták a perivaszkuláris Wharton kocsonya izolálásával, hogy a CFU-F frekvencia 1:300. Azonban Lu és társai (2006) megmutatták, hogy ez lecsökkenhet 1:1609-re, ha az egész köldökzsinór szövetet ledarálják, ami azt bizonyítja, hogy a perivaszkuláris régió tartalmazza a mesenchymális őssejtek legmagasabb koncentrációját a Wharton kocsonyán belül.
Sarugaser R et al. (2005) Stem Cells 23:220-229.
Lu L et al. (2006) Haematologica 91:1017-1026.
De a valódi terápiás értékkel bíró sejteket általában nagy számban alkalmazzák. Például, egy szisztémás megbetegedés kezelésére általában több száz millió sejtre van szükség. Ez azt jelenti, hogy a Wharton kocsonyából származó sejteket fel kell szaporítani ahhoz, hogy megfeleljenek egy terápiás dózisnak. Ezt szemlélteti az alábbi példa: A sejtek teljes száma a köldökzsinórban az előzetes számítások alapján, 11 millió sejt/gramm9. Ezeknek kb. 80 %-a a köldökzsinór ereit teszi ki, a maradék 20 % pedig a Wharton kocsonyában található. Egy tipikus köldökzsinór begyűjtés során a születés után ez egy családi bankba kerül, és kb. 35 millió Wharton kocsonya sejtet tartalmaz – ezt néha úgy írják le, mint egy “kezelésre kész dózis” – de ez kevesebb, mint amennyire szükség lenne egy felnőtt ízületi kopásos térdének kezelésére10. A sejt szaporítás ezért általában elengedhetetlen a mesenchymális őssejtek felhasználásához.
A jelenlegi klinikai célkitűzések
2008-ban történt az első köldökzsinór szövet eredetű mesenchymális őssejt klinikai kísérleti felhasználása, 2015 végéig pedig 95 esetben alkalmazták világszerte ezt a fajta kezelést különböző indikációk esetén7. A legtöbb ilyen vizsgálat középpontjában ezeknek a lenyűgöző sejteknek az immunrendszerre gyakorolt fontos hatása áll. A szülők közül sokan tudják már manapság, hogy a legjobb hely ahol nemzetközi adatokat találhatnak a jelenleg folyó klinikai kutatásokról, az egy amerikai kormány webhely, a ClinicalTrials.gov. Ahhoz, hogy megtaláljuk a kutatások eredményeit, meg kell keresni őket az orvosi irodalomban. A publikált tanulmányok azt mutatják, hogy a köldökzsinór szöveti sejtek is biztonságosan alkalmazhatók a klinikai gyakorlatban, illetve számos betegség esetében jótékony terápiás hatást fejtenek ki. Ahogy az gyakran előfordul az alapvető kutatásokban, a publikált klinikai jelentések szerint, a sejt izolációs módszerek különböző típusait alkalmazzák, így ez megszünteti a terápiás előnyök nyújtotta összehasonlítási alapot. Nagyobb átláthatóságra van szükség a szakirodalomban, amely az izolált sejtpopulációkat írja le, és ennek kell alapját képeznie a közösségi konszenzus leírásának a köldökzsinór anatómiai struktúrájáról, különös tekintettel a benne található Wharton kocsonyáról.
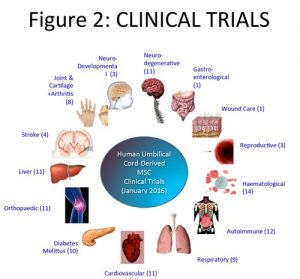
- kép: Klinikai vizsgálatok
Human Umbilical Cord-Derived MSC Clinical Trials (January 2016): Emberi köldökzsinór eredetű mesenchymális őssejtek – Klinikai Vizsgálatok (2016 Január)
Neurodegenerative: Neurodegeneratív (11), Gastroenterological: Gasztroenterológiai (1), Wound care: Sebkezelés (1), Reproductive: Szaporító szervi (3), Haematological: Hematológiai (14), Autoimmune: Autoimmun (12), Respiratory: Légzőszervi (9), Cardiovascular: Szív- és Érrendszeri (11), Diabetes Melittus: Cukorbetegség (10), Orthopaedic: Ortopédiai (11), Liver: Máj (11), Stroke: Agyvérzés (4), Joint and Cartilage + Arthritis: Ízületi, porc + Ízületi gyulladás (8), Neuro-Development: Idegi fejlesztés (3)
Az akadályok ellenére, biztos vagyok benne, hogy a Wharton kocsonyából nyerhető mesenchymális őssejtek egyedülálló terápiás értéke egyre több betegség esetén felhasználható lesz. Az utóbbiak közé tartozik a genetikailag módosított Wharton kocsonya sejtek alkalmazása, melyek szállítóként szolgálnak a monoklonális antitestek11 számára; a Wharton kocsonya sejtek egyidejű beadása előzményként vagy kiegészítésként, mint szerv transzplantáció; illetve az orvosi ellenintézkedések egy esetleges biofegyver használata ellen – ezeket nyomon követheti a hírlevél következő kiadásaiban.
- E. Davies BDS,PhD, DSc, FBSE, a Bioanyagok és Orvosbiológiai Mérnöki Egyetem professzora a Toronto-i Egyetem Fogorvos Tudományi Karán, valamint az Alkalmazott Tudományok, a Technika és Orvostudomány Karokon is tart fakultációkat. Több, mint 200 tudományos közleményt publikált, 2 könyvet szerkesztett, és számos szabadalmat nyújtott be, melyek közül közel 70 az ember köldökzsinór perivaszkuláris zónájából származó sejtekre fókuszál. Ő az alapító elnöke a Terápiás Szövetregenerációs Testületnek (TRT), mely egy Toronto-ban létrejött mesenchymális őssejtekkel foglalkozó cég. A TRT nem nyújt szolgáltatásokat a közösség számára, viszont engedélyezteti a technológiáját további cégek számára, hogy biztosítsa a családi őssejt bankolást négy különböző kontinensen.
Referenciák:
- Cord Blood Industry Report 2015; CordBloodIndustryReport.org
- Couto PS May 2014; Storage of Mesenchymal Stem/Stromal cells in family stem cell banks: What do they offer?
- Tissue Regeneration Therapeutics Inc. www.VeryPowerfulBiology.com
- Can A, Karahuseyinoglu S. 2007; Concise Review: Human Umbilical Cord Stroma with Regard to the Source of Fetus-Derived Stem Cells. Stem Cells 25:2886–2895.
- Kita K, et al. 2010; Isolation and Characterization of Mesenchymal Stem Cells From the Sub-Amniotic Human Umbilical Cord Lining Membrane. Stem Cells Dev. 19(4):491–502.
- Davies JE et al 2017; Mini-review. Stem Cells Translational Medicine. In Press
- Cell Trials Data CellTrials.org
- Nanaev AK, Kohnen G, Milovanov AP, et al. 1997; Stromal differentiation and architecture of the human umbilical cord. Placenta 1997;18:53–64.
- Schugar RC et al. 2009; High harvest yield, high expansion, and phenotype stability of CD146 mesenchymal stromal cells from whole primitive human umbilical cord tissue. J. Biomed. Biotechnol. 2009:789526.
- Centeno C et al. 2015; A dose response analysis of a specific bone marrow concentrate treatment protocol for knee osteoarthritis. BMC Musculoskeletal Disorders 16:258
- Braid LR et al. 2016; Engineered Mesenchymal Cells Improve Passive Immune Protection Against Lethal Venezuelan Equine Encephalitis Virus Exposure. Stem Cells Trans Med doi: 10.5966/sctm.2015-0341
https://parentsguidecordblood.org/en/news/umbilical-cord-tissue-cells-challenges-and-promise